Elektronenpaarbindung
Die Elektronenpaarbindung, auch kovalente Bindung oder Atombindung genannt, ist eine chemische Bindung, bei der sich Atome Elektronenpaare teilen. Diese Bindung tritt hauptsächlich zwischen Nichtmetallen auf und ermöglicht es den beteiligten Atomen, die Edelgaskonfiguration zu erreichen.
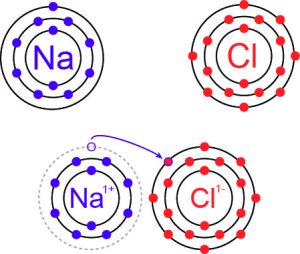
Im Gegensatz dazu basiert die Ionenbindung auf der elektrostatischen Anziehung zwischen positiv und negativ geladenen Ionen, die durch den vollständigen Transfer von Elektronen zwischen Atomen entstehen (Stichwort: Elektronenübertragung, Oxidation, Reduktion).

Vergleich: Elektronenpaarbindung und Ionenbindung
Ein wichtiger Unterschied zwischen Elektronenpaar- und Ionenbindung liegt in der Art der Elektronenbewegung:
Elektronenpaarbindung
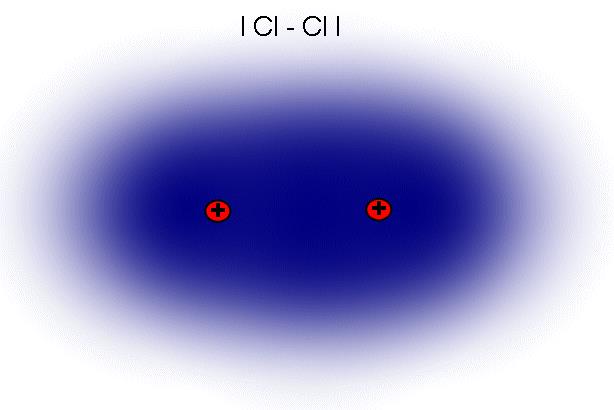
(A) Elektronenpaarbindung: Überlappen zwei unvollständige Kugelwolken von Atomen, so entstehen Misch-Kugelwolken (Bindungswolken). Die Atome teilen sich nun Elektronen in Elektronenpaaren (A). Die Elektronen liegen in Zweierpärchen in einer Bindungwolke vor, womit sie sich nicht von einer Kugelwolke unterscheiden. Dieses Elektronenpaar wird von beiden Bindungspartnern angezogen. Gleichzeitig stoßen sich aber auch die Elektronen gegenseitig ab (B). Dadurch wandern die zwei Bindungelektronen zwischen ihren Bindungspartnern hin und her (C).
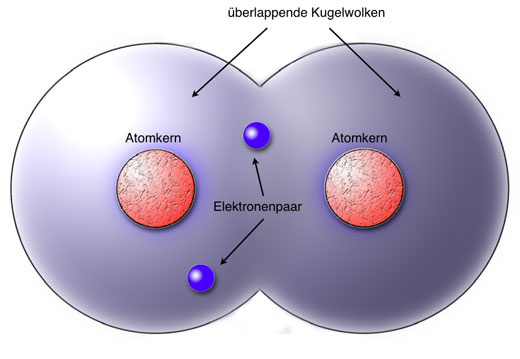
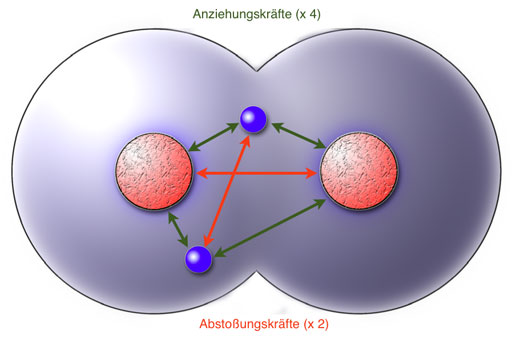
Ionenbindung
(B) Ionenbindung: Ein Atom gibt Elektronen ab (Oxidationsreaktion), während ein anderes diese aufnimmt (Reduktionsreaktion), wodurch Ionen (Katione und Anione) entstehen.

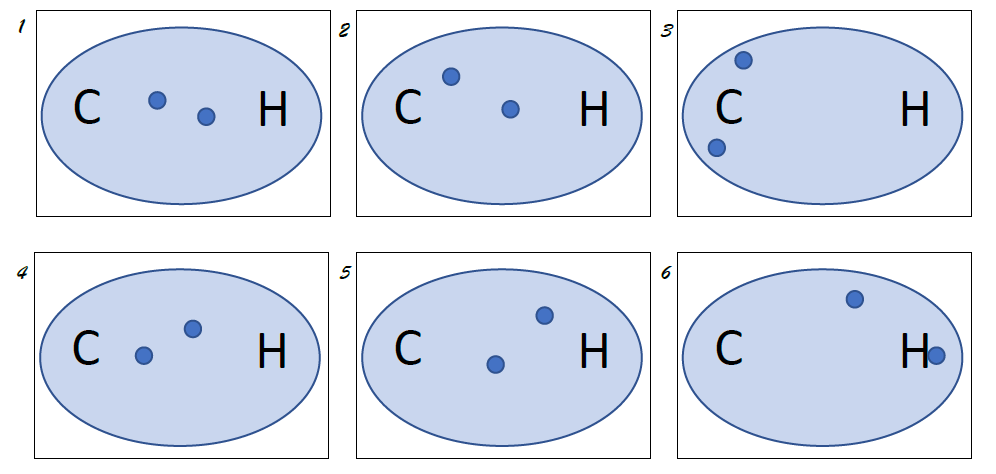
Und jetzt du!
Aufgabe: Zeichne die zwei Bindungen zwischen Sauerstoff (O) und zwei Wasserstoffatomen (H). Es entsteht das Molekül H2O

Nochmal zur Elektronenpaarbindung...
Zusammenhang der Elektronenpaarbindung und der Elektronegativität
Bei der Elektronenpaarbindung ist die Elektronegativität entscheidend. Elemente mit ähnlicher Elektronegativität bilden eher kovalente Bindungen, während bei großer Elektronegativitätsdifferenz Ionenbindungen bevorzugt werden. Man sagt, dass in der Regel alle ΔEN>1,7 zu einer Ionenbindung führen. Alle darunter führen zu einer Elektronenpaarbindung. Man muss allerdings beachten, dass dies nur eine Faustregel ist und kein naturwissenschaftliches Gesetz.
Genauso wie man Ionenverbindungen Salze nennt, wird ein Verbund aus Atomen (nicht Ione!) über Elektronenpaarbindungen als Molekül bezeichnet.

Zusammenhang von Elektronegativität und Elektronenpaarbindung
Die Elektronegativität eines Elements beschreibt ein Maß über seine Fähigkeit, Elektronen in einer Bindung anzuziehen. Je größer die Elektronegativität, desto stärker zieht ein Atom die Bindungselektronen an.
Da Atome unterschiedlich stark an ihren Bindungselektronen ziehen können, kommt es zur Verschiebung der Elektronen innerhalb ihrer Bindung.
Dadurch verlagern sich die Elektronen eher zum einen oder zum anderen Bindungspartner. Es entstehen keine formalen Ladungen, aber so genannte Partialladungen (Teilladungen).
Sind die Elektronen in der Bindung A-B eher zum Bindungspartner A verlagert, so hat dieser einen negative Teilladung δ-. Dadurch hat der Bindungspartner B eine positive Teilladung δ+.
Eine solche Ladungsverschiebung nennt man auch Dipolmoment. Ein Dipolmoment wird formal als Maß für die räumliche Ladungstrennung, also die Stärke des Dipolcharakters, definiert.
Zusammengefasst heißt das also, Elektronenpaarbindungen können polar oder unpolar sein, abhängig von der Differenz der Elektronegativitäten der beteiligten Atome und der daraus resultierenden Elektronenverschiebung:
(1) Unpolare Elektronenpaarbindung: Die Elektronen werden gleichmäßig zwischen den Atomen geteilt.
(2) Polare Elektronenpaarbindung: Die Elektronen werden ungleichmäßig geteilt, was zu einem Dipolmoment führt. Es liegen Partialladungen vor.
Abbildungen


Ein ausführliches Video zur Einführung in die Elektronenpaarbindung:
Transkript: "Wenn alle teilen, haben alle was davon", das ist das Prinzip der Atombindung. Atome sind ja alleine schon spannend, aber richtig interessant wird es doch erst, wenn sich mehrere Atome zu Verbindungen zusammentun...
Erklärung des Unterschieds zwischen Elektronenpaarbindung und Ionenbindung:
Transkript: "So Leute, komisch ionische und metallische Bindungen haben wir euch schon in unseren anderen Videos vorgestellt und erklärt, aber wo bleibt denn die einfachste und die übliche Bindung zwischen Elementen?..."
Zusammenhang zwischen Elektronegativität und Elektronenpaarbindung:
Transkript: "Chemie endlich verstehen, heute mit dem Thema Moleküle und die Elektronenbindung. Als wichtiges Vorwissen solltet ihr Schalenmodell und die Elektronenschreibweise mitbringen..."

Aufgaben zur Vertiefung
Aufgabe 1: Erkläre den Unterschied zwischen Elektronenpaarbindung und Ionenbindung.
Aufgabe 2: Zeichne die Lewis-Struktur eines Wassermoleküls (NH3) und erkläre, warum es eine polare Elektronenpaarbindung ist.
Aufgabe 3: Untersuche die Bindungsverhältnisse in einem Siliciumwasserstoffmolekül (SiH4) und beschreibe, warum es sich um eine unpolare Elektronenpaarbindung handelt.
"Plus"-Aufgabe: Recherchiere, was ein Dipol ist (siehe Hilfen). Erläutere, warum das Molekül CO2 kein Dipol ist.

Hilfen und Quellen
Link 1: LeifiChemie: Elektronenpaarbindung
Link 2: Seilnacht: Elektronenpaarbindung
Link 3: Studyflix: Kovalente Bindung
Link 4: Schubu: Elektronenpaarbindung
Link 5: LeifiChemie: Elektronegativität